Grafik: AWMF
Medikamente: Schnellerer Marktzugang
Neue Medikamente kommen immer rasanter auf den Markt und sie haben ihren Preis. Damit haben unter anderem die gesetzlichen Krankenkassen (GKV) zu kämpfen. Ihnen will der Gesetzgeber nun helfen – das allerdings könnte den Fortschritt maßgeblich bremsen, fürchtet die Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Sie begrüßt grundsätzlich die Pläne der Politik, die Arzneimittelversorgung langfristig zu stabilisieren.
In der aktuellen Stellungnahme zum GKV-Finanzstabilisierungsgesetz heißt es:
„Das erwartete finanzielle Defizit in der gesetzlichen Krankenversicherung zwingt den Gesetzgeber zu kurzfristigen Maßnahmen. Wir unterstützen die Bestrebungen zum Erhalt der Stabilität durch nachhaltige Strategien und sehen bei der Arzneimittelversorgung auch die Chance zur Korrektur im Sinne eines lernenden Systems. Einige der vorgeschlagenen Änderungen erleben wir als unausgewogen, sogar als gefährlich.“
Dies betreffe:
1. Die initiale Preisbildung
In den vergangenen Jahren gab es rasche Fortschritte bei der Entwicklung wirksamer Arzneimitteltherapien: In der Onkologie bietet beispielsweise die personalisierte Medizin neue Arzneimitteltherapien und für Hepatitis B und C wurden ebenfalls neue, hochwirksame Medikamente entwickelt. Mit dem Arzneimittelfortschritt gingen Kostensteigerungen einher. Auf diese hatte der Gesetzgeber reagiert und zum 1. Januar 2011 mit dem Arzneimittelmarktneuordnungsgesetz (AMNOG) eine frühe Nutzenbewertung für alle neu zugelassenen Arzneimittel eingeführt. Sie bildet seither die Grundlage der Preisbildung für neu zugelassene Arzneimittel. Bei allen positiven Effekten in der Versorgung mit innovativen Arzneimitteln haben sich dadurch die Einstiegspreise vieler Medikamente deutlich erhöht.
„Wir unterstützen deshalb grundsätzlich die Begrenzung der initialen Preisbildung auf ein Niveau, das mit der Stabilität der gesetzlichen Krankenversicherung vereinbar ist“, betont Prof. Dr. Rolf-Detlef Treede, Präsident der AWMF. „Trotzdem sehen wir die jetzt vorgesehenen Anpassungen mit großer Sorge“, betont Treede, „denn ein fehlender Nachweis des Zusatznutzens innerhalb eines Jahres bedeutet nicht, dass es keinen Nutzen gibt“.
2. Kategorien der frühen Nutzenbewertung neuer Arzneimittel
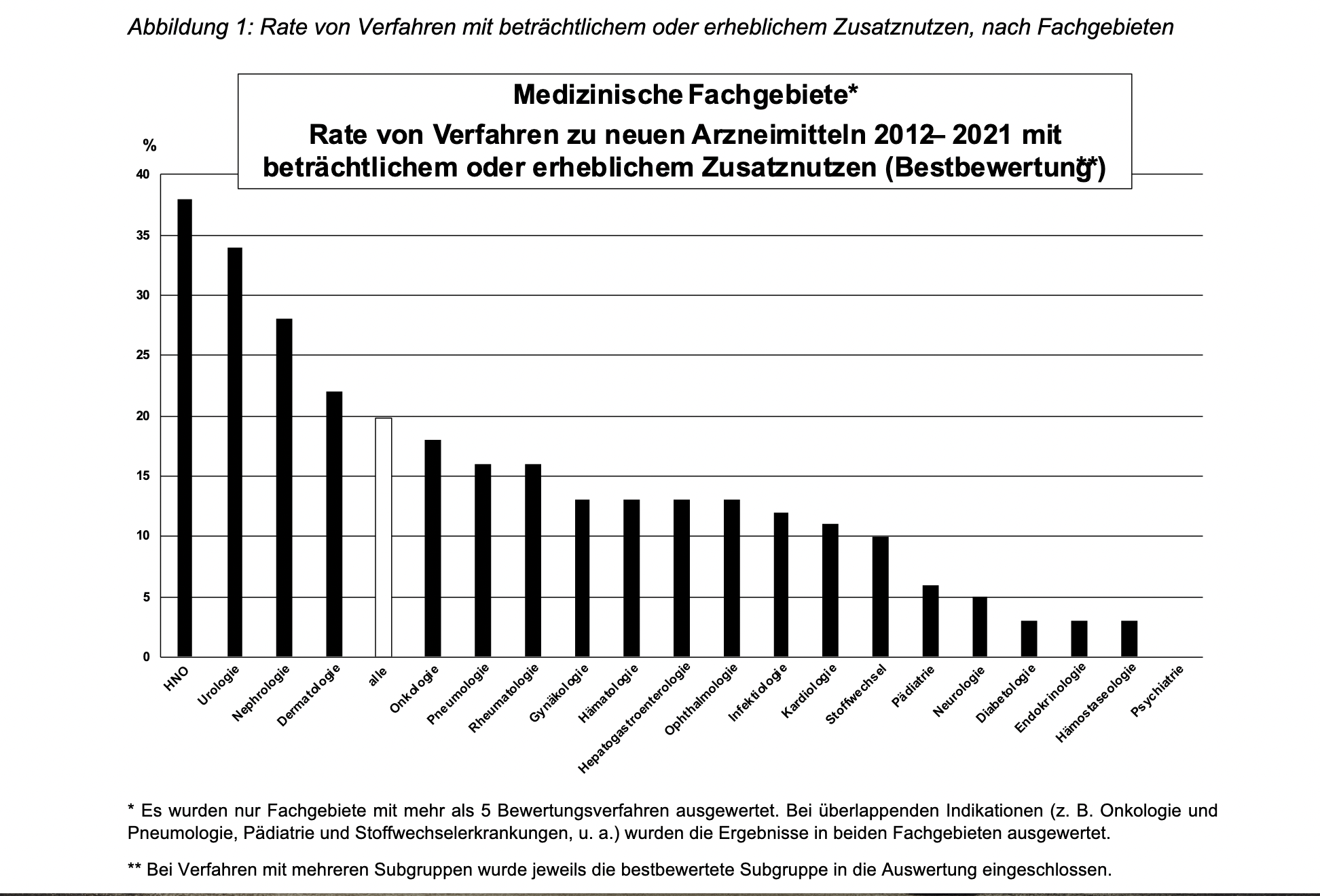
Bislang wird der Zusatznutzen in vier Kategorien bewertet: gering, beträchtlich, erheblich oder nicht quantifizierbar.
Künftig soll es nur noch für die beiden obersten Kategorien einen höheren Preis gegenüber der Zweckmäßigen Vergleichstherapie (ZVT) geben können. Gemessen an den bisherigen Erfahrungen wären das noch 20 % der neuen Arzneimittel statt bisher 56%, führt Treede aus und mahnt: Damit würde ein wesentlicher Anreiz zur Verfügbarkeit neuer Arzneimittel in Deutschland wegfallen.
Negative Auswirkung auf innovative Medikamente
Dieser Aspekt wirke sich vor allem negativ auf innovative Arzneimittel für chronische Erkrankungen aus wie sie in der Diabetologie, Endokrinologie, Hämostaseologie oder Psychiatrie besonders häufig seien. „Hier würde aus methodischen Gründen fast nie ein so positiver Zusatznutzen gesehen wie beispielsweise in der Onkologie“, betont Prof. Dr. Bernhard Wörmann, Vorsitzender der Ständigen Kommission Nutzenbewertung von Arzneimitteln der AWMF. Die bisherige Methodik der frühen Nutzenbewertung mit vier Kategorien müsse daher beibehalten werden. Zusätzlich sollten Parameter wie Patient-Reported-Outcome und Lebensqualität stärker gewichtet werden.
3. Arzneimittel für seltene Erkrankungen
Der medizinische Zusatznutzen bei diesen Arzneimitteln gilt in Deutschland zurzeit automatisch dann als belegt, wenn ein Medikament bereits von der Europäischen Arzneimittel-Agentur (European Medicines Agency, EMA) als sogenanntes „Orphan Drug“ zugelassen ist. Das allerdings bringt der AWMF zufolge Schwierigkeiten mit sich. Daher heißt es in der Stellungnahme: „Wir schlagen vor, die Förderung der Entwicklung von Arzneimitteln für seltene Erkrankungen auf Indikationen zu beschränken, deren Inzidenz und Prävalenz in Deutschland niedrig ist.“ Im Bereich der personalisierten Medizin könnten das auch biologisch definierte Subgruppen innerhalb von Volkskrankheiten sein.
4. Zusätzliche, späte Nutzenbewertung
Zu kurz greift aus Sicht der Fachgesellschaft auch, dass man sich auf die frühe Nutzenbewertung beschränkt. Das liegt unter anderem daran, dass eine langfristige Verbesserung der Lebensqualität und Funktionalität im Alltag komplizierter nachzuweisen ist als eine kurzfristige Verminderung der Sterblichkeit. Daher schreiben die Fachleute: „Wir schlagen die Etablierung einer zusätzlichen, späteren Nutzenbewertung vor. Eine spätere Nutzenbewertung hat aufgrund umfangreicherer Daten und längerer Nachbeobachtungszeiten eine höhere Wahrscheinlichkeit, den ‚wahren‘ Wert eines Arzneimittels zu erfassen.“ Bei einer erneuten Preisverhandlung sollten schließlich gesundheitsökonomische Daten ebenso berücksichtigt werden. Treede fasst zusammen: „Auch bei der Versorgung mit neuen Arzneimitteln benötigen wir nicht nur rasche Symptomlinderung, sondern langfristige Therapiekonzepte.“
Erhalten Sie jetzt uneingeschränkten Zugriff auf alle interessanten Artikel.
- Online-Zugriff auf das PM-Report Heftarchiv
- Aktuelle News zu Gesundheitspolitik, Pharmamarketing und alle relevanten Themen
- 11 Ausgaben des PM-Report pro Jahr inkl. Specials

