
Am Anfang im Geschäftsbericht stellt sich der G-BA in Zahlen vor. (Foto: Screenshot G-BA Geschäftsbericht 2023 / PM—Report)
In 2023 haben „viele Entscheidungen des G-BA über das Beschlussjahr hinaus eine Versorgungsrelevanz für gesetzlich Versicherte wie das DMP Adipositas, die neue obere Altersgrenze beim Brustkrebsscreening oder die neue Richtlinie zur Versorgung von Menschen mit Long COVID und ähnlichen Erkrankungen entwickelt.“
Ein Aspekt im Geschäftsbericht ist die europäische Nutzenbewertung (ab S. 26), der „wir schrittweise näher kommen und im kommenden Jahr auf die Zielgerade einbiegen werden.“ In dem Kapitel geht Josef Hecken auf die „geheimen Preise“ bei neuen Medikamenten ein.
Ein anderer Punkt sind die Beschlüsse zur Nutzenbewertung neuer Arzneimittel: „Der Gesetzgeber hat dieses sogenannte AMNOG-Verfahren 2022 um eine neue Maßnahme ergänzt: Für freie Kombinationstherapien mit mehreren neuen Wirkstoffen gilt künftig ein 20-prozentiger Preisabschlag. Im Jahr 2023 passte der G BA dazu seine Arzneimittel-Richtlinie an und benannte erstmals Kombinationen.“
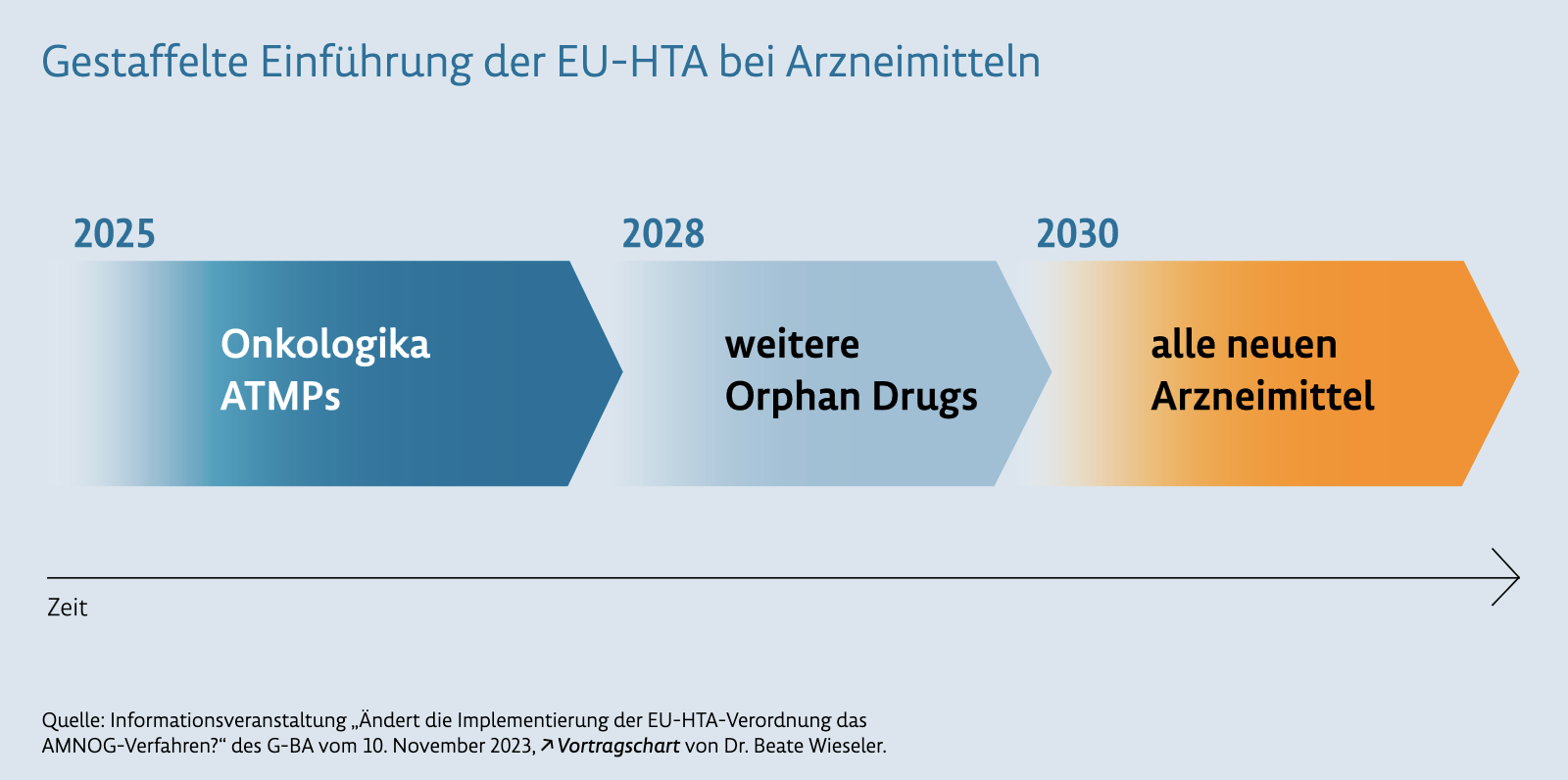
EU-HTA: Zentrale Nutzenbewertung von neuen Arzneimitteln
Dazu steht im Geschäftsbericht:
„Den nationalen Nutzenbewertungen wird künftig eine gemeinsame Bewertung der Ergebnisse der klinischen Studien vorangestellt, ein sogenanntes Health Techno logy Assessment (HTA). Die Ergebnisse dazu werden ab dem Jahr 2025 in EU HTA Berichten (Joint Clinical Assessment (JCA) Reports) zusammengefasst. Sie stellen künftig zu allen in den Mitgliedsstaaten relevanten Fragestellungen1 dar, welche Daten die vom Hersteller eingereichten (Zulassungs-)Studien mit welcher Aussagesicherheit dazu bereit halten. Die Fragestellungen können in den Mitgliedsstaaten sehr unterschiedlich aussehen. Therapiestandards, Patientenpopulationen, Finanzierungssysteme, die Verfügbarkeit in der Versorgung – und damit auch mögliche Vergleichstherapien – unterscheiden sich zum Teil erheblich. Perspektivisch soll das EU-HTA-Verfahren auch bei Medizinprodukten angewendet werden.
Fest steht: Die gemeinsame Bewertung auf EU-Ebene wird die nationalen Nutzenbewertungen bei neuen Arzneimitteln nicht ersetzen. Sie geht ihr voraus und muss künftig bei der nationalen Bewertung berücksichtigt werden. Die Schlussfolgerungen zum Zusatznutzen der neuen Wirkstoffe, deren Erstattung durch die Kostenträger sowie die Preisbildung bleiben aber weiterhin in nationaler Verantwortung. Reichen einzelnen Mitgliedsstaaten die zentral verfügbaren Daten und EU Analysen noch nicht aus, werden sie weiterhin bei den Herstellern ergänzende zusätzliche Informationen und Daten anfordern können.“
Prof. Josef Hecken, Unparteiischer Vorsitzender des G-BA und Vorsitzender der Unterausschüsse Arzneimittel, Bedarfsplanung und Zahnärztliche Behandlung, findet, dass „wir mit der EU-HTA-Bewertung einen Gewinn an Transparenz erhalten. Umso unverständlicher ist es nun, dass der Gesetzgeber mit dem Medizinforschungsgesetz bei uns geheime Erstattungsbeträge etablieren will.
Bei ,geheimen Rabatten‘ ergeben sich vielfältige Reibungsverluste. Für die Außenwelt – Ärztinnen und Ärzte sowie Patientinnen und Patienten in Deutschland, aber auch innerhalb der EU – wäre nicht mehr nachvollziehbar, inwiefern der festgestellte Zusatznutzen überhaupt noch einen Einfluss auf die Preise der Arzneimittel hat. Das verletzt eines der Kernprinzipien des AMNOG und des Konzepts der Value-based Healthcare: nur ein höherer Patientennutzen rechtfertigt auch einen höheren Preis.“
Und Hecken legt noch nach: „Transparenz als Voraussetzung für Vergleichbarkeit brauchen wir auch bei den Arzneimittelpreisen. Das schließt für mich Informationen über Kosten von Forschung, Produktion und Marketing sowie Angaben zu Fördermitteln aus öffentlicher Hand mit ein. Nur wenn es hierzu Transparenz gibt, kann die nationale Politik die richtigen Entscheidungen zu Preisinstrumenten treffen.“
Benennen von Kombinationstherapien
So benennt der G-BA seit November 2022 in allen Beschlüssen zur Nutzenbewertung im AMNOG-Verfahren die jeweiligen Kombinationswirkstoffe:
„Neue Arzneimittel können nicht nur allein, sondern auch als Teil einer Kombinationstherapie eingesetzt werden. Vor allem in der Onkologie kommt das häufig vor. Bei den Kombinationstherapien mit neuen Wirkstoffen handelt es sich um Arzneimittel, für die jeweils Schutzrechte bestehen, kein generischer Wettbewerb vorliegt und die in der Regel ein hohes Preisniveau auf weisen.“
Damit Kosten gedämpft werden können, „soll für freie Kombinationen, in denen sich hohe Preise der jeweiligen Arzneimittel summieren können, künftig ein pauschaler Abschlag von 20 Prozent greifen. Davon ausgenommen, wer den Kombinationen, die einen mindestens beträchtlichen Zusatznutzen aufweisen.“
Den G-BA Geschäftsbericht (PDF, 60 Seiten) finden Sie hier. Leserinnen und Lesern, die tiefer in bestimmte Themen einsteigen wollen, werden über Links bzw. QR-Codes weiterführende Informationen auf der G-BA-Website angeboten.
Grafik: G-BA
Erhalten Sie jetzt uneingeschränkten Zugriff auf alle interessanten Artikel.
- Online-Zugriff auf das PM-Report Heftarchiv
- Aktuelle News zu Gesundheitspolitik, Pharmamarketing und alle relevanten Themen
- 11 Ausgaben des PM-Report pro Jahr inkl. Specials

